|
7. Идеальный газ. Основное уравнение МКТ идеального газа. Температура и ее измерение. Абсолютная температура
1. Понятие идеального газа, его свойства. 2. Объяснение давления газа. 3. Необходимость измерения температуры. 4. Физический смысл температуры. 5. Температурные шкалы. 6. Абсолютная температура. 7. Распространенные ошибки
Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. Идеальным принято считать газ, если: а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела; б) газ очень, разрежен, т. е. расстояние между молекулами намного больше размеров самих молекул; в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел овойства идеального, осуществляются при соответстсвующем разрежении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. Основными параметрами идеального газа являются давление, объем и температура.
Одним из первых и важных успехов МКТ было Качественное и количественное объяснение давления газа на стенки сосуда. Качественное объяснение заключается и том, что молекулы газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела и передают свои импульсы стенкам сосуда.
На основании использования основных положений молекулярно-кинетической теории было получено основное уравнение МКТ идеального газа, которое выглядит так: 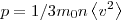 , где , где 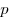 — давление идеального газа, — давление идеального газа, 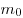 — масса молекулы, — масса молекулы, 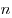 — концентрации молекул, — концентрации молекул, 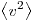 — среднее значение квадрата скоростой молекул. Если представить себе фантастическую ситуацию, в которой нам известны скорости всех молекул и единице объема, то — среднее значение квадрата скоростой молекул. Если представить себе фантастическую ситуацию, в которой нам известны скорости всех молекул и единице объема, то 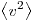 можно было бы вычислить по формуле можно было бы вычислить по формуле
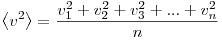
Величина 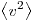 позволяет ввести представление о сродной кинетической энергии поступательного движения молекул идеального газа позволяет ввести представление о сродной кинетической энергии поступательного движения молекул идеального газа 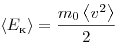 . Тогда основное уравнение МКТ идеального газа можно записать в виде: . Тогда основное уравнение МКТ идеального газа можно записать в виде: 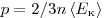 . .
Однако, измерив только давление газа, невозможно уанатъ ни среднее значение кинетической энергии молекул по отдельности, ни их концентрацию. Следовательно, для нахождения микроскопических параметром газа нужно измерение еще какойто физической величины, связанной со средней кинетической энергией молекул. Такой величиной является температура. Температура — скалярная физическая величина, описывающая состояние термодинамического равновесия (состояния, при котором не происходит изменения микроскопических параметров). Как термодинамическая величина температура характеризует тепловое состояние системы и измеряется степенью его отклонения от принятого за нулевое, как молекулярно-кинетическая величина — характеризует интенсивность хаотического движения молекул, измеряется их средней кинетической энергией: 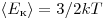 где где 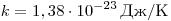 и называется постоянной Больцмана. и называется постоянной Больцмана.
Температура всех частей изолированной системы находящейся в равновесии, одинакова. Измеряется температура термометрами в градусах различных температурных шкал. Существует абсолютная термодинамическая шкала (шкала Кельвина) и различные эмпирические шкалы, которые отличаются начальными точками. До введения абсолютной шкалы температур в практике широкое распространение получила шкала Цельсия (за О°С принята точка замерзания воды, за 100°С принята точка кипения воды при нормальном атмосферном давлении).
Единица температуры по абсолютной шкале называется Кельвином и выбрана равной одному градусу по шкале Цельсия 1 К = 1 °С. В шкале Кельвина за нуль принят абсолютный нуль температур, т. е. температура, при которой давление идеального газа при постоянном объеме равно нулю. Вычисления дают результат, что абсолютный нуль температуры равен -273 °С. Таким образом, между абсолютной шкалой температур и шкалой Цельсия существует связь Т = t °С + 273. Абсолютный нуль температуры недостижим, так как любое охлаждение основано на испарении молекул с поверхности, а при приближении к абсолютному нулю скорость поступательного движения молекул настолько замедляется, что испарение практически прекращается. Теоретически при абсолютном нуле скорость поступательного движения молекул равна нулю, т.е. прекращается тепловое движение молекул.
Распространенные ошибки
1. Не всегда правильно объясняют экзаменуемые различие между идеальными и реальными газами. Были, например, такие ответы: «Идеальный газ — это реальный газ без примесей», «Идеальный газ — это реальный газ при низкой температуре» и т. п.
Слово «идеальный» означает «воображаемый, реально не существующий». Реальный газ отличется от идеального наличием взаимодействия молекул. При малых плоностях в нем преобладают силы притяжения, что приводит к появлению дополнительного давления: газ как бы сжимает сам себя. При больших плотностях действуют силы отталкивания, вследтсвие чего молекула не допускает проникновения других молекул в занимаемый ею объем. Пренебрегать собственным объемом молекул реального газа нельзя.
При не слишком высоком давлении (например, при атмосферном) и не слишком низкой температуре (например, при комнатной) реальный газ с достаточной степенью точности подчиняется законам идеального газа.
 Оставить комментарий Оставить комментарий
 Сообщить об ошибке Сообщить об ошибке
| 
