|
6. Опытное обоснование основных положений молекулярно-кинетической теории строения вещества. Масса и размеры молекул
1. Основные положения. 2. Опытные доказательства. 3. Микрохарактеристики вещества. 4. Распространенные ошибки.
Молекулярно-кинетическая теория (МКТ) — это раздел физики, изучающий свойства различных состояний вещества, основывающийся на представлениих о существовании молекул и атомов как мельчайших частиц вещества. В основе МКТ лежат три основных положения:
1. Все вещества состоят из мельчайших частиц: молвкул, атомов или ионов.
2. Эти частицы находятся в непрерывном хаотическом движении, скорость которого определяет температуру вещества.
3. Между частицами существуют силы притяжеиия и отталкивания, характер которых зависит от расстояния между ними.
Основные положения МКТ подтверждаются многими опытными фактами. Существование молекул, атомов и ионов доказано экспериментально, молекулы достаточно изучены и даже сфотографированы с помощью электронных микроскопов. Способность газов неограниченно расширяться и занимать весь предоставленный им объем объясняется непрерывным хаотическим движением молекул. Упругость газов, твердых и жидких тел, способность жидкостей смачивать некоторые твердые тела, процессы окрашивания склеивания, сохранения формы твердыми телами и многое другое говорят о существовании сил притяжения и отталкивания между молекулами. Явление диффузии — способность молекул одного вещества проникать в промежутки между молекулами другого — тоже подтверждает основные положения МКТ. Явлением диффузии объясняется, например, распространение запахов, смешивание разнородных жидкостей, процесс растворения твердых тел в жидкостях, сварка металлов путем их расплавления или путем давления. Подтверждением непрерывного хаотического движения молекул является также и броуновское движение — непрерывное хаотическое движение микроскопических частиц, нерастворимых жидкости.
Движение броуновских частиц объясняется хаотическим движением частиц жидкости, которые сталкиваются с микроскопическими частицами и приводят их в движение. Опытным путем было доказано, что скорость броуновских частиц зависит от температуры жидкости. Теорию броуновского движения разработал А. Эйнштейн. Законы движения частиц носят статистический, вероятностный характер. Известен только один способ уменьшения интенсивности броуновского движения — уменьшение температуры.
Массы молекул очень малы, и удобно использовать не абсолютные значения масс, а относительные. Относительные массы атомов и молекул были определены еще очень давно. Относительные атомные массы всех химических элементов указаны в таблице Менделеева. Физическими методами, например по движению ионов в электрическом и магнитном полях, удалось определить массы некоторых атомов в абсолютных единицах. Так появилась атомная единица массы (а. е. м.), равная 1/12 массы атома углерода.
Итак, 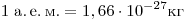 . Поскольку относительная молекулярная масса . Поскольку относительная молекулярная масса 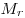 это величина, равная отношению массы молекулы данного вещества к 1/12 массы атома углерода, то относительная молекулярная масса позволяет найти массу любой молекулы или атома это величина, равная отношению массы молекулы данного вещества к 1/12 массы атома углерода, то относительная молекулярная масса позволяет найти массу любой молекулы или атома
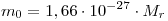
Например, для воды ( H2O )  и масса молекулы воды равна и масса молекулы воды равна 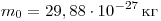 . .
Диаметром молекулы принято считать минимальное расстояние, на которое им позволяют сблизиться силы отталкивания. Однако понятие размера молекулы Является условным. Средний размер молекул порядка 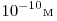 . .
Многие свойства вещества определяются только числом частиц, но не зависят от свойств частиц. Например, давление идеального газа определяется ко-центрацией частиц 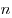 и температурой и температурой 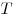 : : 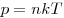 ; сила тока через проводник также зависит от свойств носителей заряда: ; сила тока через проводник также зависит от свойств носителей заряда: 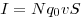 , где , где 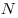 — концентрация свободных частиц, — концентрация свободных частиц, 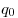 — заряд одной частицы, — заряд одной частицы, 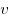 — скорость частиц, — скорость частиц, 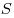 — площадь поперечного сечения проводника. Именно поэтому возникло в физике понятие количество вещества. Единица количества вещества определяется на основе соотношения для расчета числа частиц — площадь поперечного сечения проводника. Именно поэтому возникло в физике понятие количество вещества. Единица количества вещества определяется на основе соотношения для расчета числа частиц 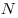 в веществе любой массы. в веществе любой массы.
Действительно, 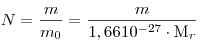 . Из этой формулы следует, что в образце, масса которого . Из этой формулы следует, что в образце, масса которого 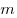 численно равна численно равна 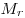 , число частиц равно , число частиц равно
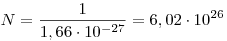 . .
При переходе к СИ было взято в качестве единицы количества вещества число в 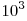 раз меньшее, т.е. раз меньшее, т.е. 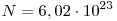 . Эта единица называется моль. . Эта единица называется моль.
Число частиц в одном моле вещества названо числом Авогадро.
Итак, 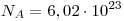 , в одном моле любого вещества содержится , в одном моле любого вещества содержится 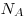 частиц. частиц.
Теперь можно найти массу одного моля 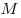 . Эта величина называется молярной массой. Действительно, по определению . Эта величина называется молярной массой. Действительно, по определению
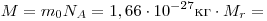
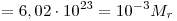 . .
Из формулы 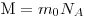 следует, что единица молярной массы вещества — следует, что единица молярной массы вещества — 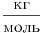 . .
1.Не все учащиеся правильно объясняют различие в характере (теплого) движения молекул в газах, жидкостях и твердых телах.
В газах молекулы находятся на достаточно больших расстояниях друг от друга, поэтому силы притяжения пренебрежимо малы, вследствие чего газы могут неограниченно расширяться. Молекулы газа хаотически движутся, соударяясь, подобно шарикам ,друг с другом и со стенками сосуда.
В жидкостям молекулы расположены практически вплотную друг к другу. Они колеблются около некоторого положения равновесия как бы « топчутся на месте», а так же пересекают из одного положения равновесия в другое.
В твердых телах молекулы и атомы располагаются в определенных местах и образуют кристаллическую решетку. Они колеблются около некоторых средних положений равновесия, называемых узлами кристаллической решетки.
2.Встречалось в ответах абитуриентов утверждения, что броуновское движение — это движение молекул, которое впервые наблюдал в микроскоп английский ученый Р. Броун. Это грубая ошибка.
Суть броуновского движения состоит в том, что достаточно мелкие твердые частицы, взвешенные в жидкости, совершают беспорядочное движение. Броун в 1827 г. впервые наблюдал в микроскоп движение этих частиц, а не молекул, невидимых в микроскоп. Броуновское движение может наблюдаться и в газе.
3.Многие школьники не имеют четкого наглядного представления о массе и размерах молекул, не могут произвести оценку этих величин. Чтобы представить себе, насколько малы молекулы и насколько велико их число, рассмотрим такой мысленный эксперимент:
Нальем в стакан  = 100 г воды и предположим, что каждую секунду из него вылетает = 100 г воды и предположим, что каждую секунду из него вылетает 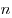 = 1 млрд = 109молекул воды. Через сколько времени из стакана вылетят все молекулы воды? = 1 млрд = 109молекул воды. Через сколько времени из стакана вылетят все молекулы воды?
Елси предложить учащимся хотя бы очень приблизительно оценить без расчетов это время, то, как правило, называют значения, очень далекие от действительного.
Вычилим время 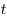 , за которое вылетят из стакана все молекулы воды. Очевидно, что , за которое вылетят из стакана все молекулы воды. Очевидно, что 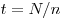 , где , где 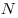 — число молекул воды, масса которой — число молекул воды, масса которой 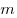 : : 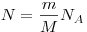 ; ; 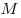 — молярная масса воды; — молярная масса воды; 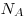 — постоянная Авогадро. Таким образом, — постоянная Авогадро. Таким образом,
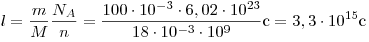 . .
| 
